Dzisiejszy temat inspirowany jest tematem z najnowszej okładki
C&EN (tygodnik dla członków Amerykańskiego Towarzystwa Chemicznego,
ACS) [1]. Otóż porusza on temat jak najbardziej na czasie, i poniekąd kontrowersyjny, czyli nanoleków i ich legalizacji.
Zacznijmy od terminologii. Ups! Oficjalnej definicji nie ma! Jak się okazuje, nawet amerykańska Agencja Żywności i Leków (
FDA), prawodawca wszelkich standardów wprowadzania leków na rynek amerykański, nie wprowadził jeszcze definicji. A powodem wymienianym na łamch artykułu jest fakt, że każdy nanolek jest specificzny w swoim zastosowaniu, czyli i w swoim składzie, a co za tym idzie ma specyficzny zestaw metod charakteryzujących dany lek. FDA nie chcąc ograniczać szeroko pojętej definicji nanoleków postanowiła nie wprowadzać konkretów, jedynie niezobowiązujące poradniki. I tak, z jednej strony daje pole do popisu badaczom, a z drugiej sprawia że Ci ostatni nie mają pojęcia do jakiego stopnia powinni przeprowadzać wszelkie analizy fizykochemiczne itd, zapewniające wprowadzenie ich produktu na rynek. Jak widać, błachy początek artykułu, a tu już problem z definicją.
Wracając do przedmiotu posta.
Nanolek to złożona struktura, gdyż składa się nie tylko z składnika aktywnego (jak to ma miejsce w niskocząsteczkowych lekach dostępnych na rynku), ale również z inżynieryjnie dopracowanego systemu dostarczającego ten składnik do miejsca docelowego (
drug delivery system). W skrócie, nanolek to odpowiednio skonstruowane połączenie nośnika leku i samego leku, który ułatwia docelowy transport do chorych komórek, a tam uwalnia się w odpowiednio zaprogramowany sposób. Bazą nośnika są struktury na bazie tłuszczy, polimerów,
dendrymerów lub cukrów, a zatem niektóre nośniki mogą być bardziej przyjazne organizmowi niż formy w jakich dostarcza się składników aktywnych współcześnie. No i oczywiście, wszystko jest
nanorozmiarów.
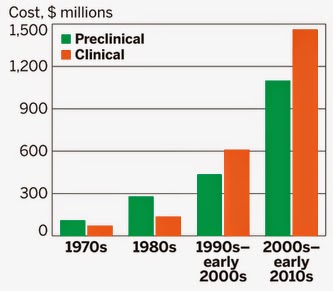
Wszystko pięknie, ale... Okazuje się, że folmuła takiego leku nie jest tak ściśle powtarzalna, jak to ma miejsce w przypadku niskocząsteczkowych leków. Przykładowo, lek
Doxil to krystaliczna
doksorubicyna zamknięta w nanokapsułce zbudowanej z
liposomów i glikolu polietylenowego (
PEG). Aby otrzymać optymalne uwalnianie leku, potrzeba specyficznych rozmiarów liposomów i PEG, które dodatkowo 'współpracują' z składnikiem aktywnym w całym mechaniźmie. Kiedy kapsułka zostaje 'naładowana' doksorubicyną, mieszanina jest następnie filtrowana do otrzymania frakcji rozmiarów ok. 100 nm, czyli takich które umożliwiają 'prześlizgnięcie' się kapsułki przez tworzące się dopiero naczynia krwionośne prowadzące do rozwijającego się guza. Widać zatem, że formuła takiego leku jest oparta na specificznej dystrybucji składników, która może się różnić z każdą partią produkowaną przez inwentora, a co dopiero gdy miałby taki lek być produkowany jako lek generyczny. I tu pojawia się problem bezpieczeństwa pacjentów, bo o ile kraje wysokorozwinięte mają tę świadomość, to inne, np. Meksyk czy Indie, mogą już takiej nie mieć. I rzeczywiście, w wspomnianym artykule autor pisze, że w tych krajach już podaje się takie leki bez pełnej analizy formuły czy skutków upocznych. Implikacją omówionych problemów z formułą nanoleków, a także faktem, że są one wciąż w fazie rozwoju, jest ich wysoka cena. Ta cena wynika też z faktu, że FDA nie wprowadziła jeszcze konkretnych wymagań dla takich leków, a zatem funkcjonują one wciaż jako leki eksperymentalne, z kilkoma wyjątkami oczywiście.
Jednak nie wdając się już w większe szczegóły chemii tych leków, ani polityki związanej z wprowadzaniem ich na rynek, zakończę tutaj ten post. Mam nadzieje, że udało mi się zainspirować zainteresowanych do dalszych poszukiwań w tym temacie.
W formie dygresji, warto nadmienić nagminne użycie przedimka 'nano-' w literaturze naukowej. Niestety, niezależnie od znaczenia nanoskali w badaniach, czy to rozmiar czy długość fali światła, naukowcy starają się często niepotrzebnie nadpisać dodatkowych cech przez użycie tego określenia. Jak zawsze, chodzi przede wszystkim o pieniądze. Pisząc grant na badania naukowe słowo 'nano-' elektryzuje potencjalnych fundawców. Czy to dobrze czy źle, polecam ocenić to samemu, ale warto się czasem zastanowić czy to 'nano-' jest potrzebne, żeby coś faktycznie działało.
Literatura:
- M. Davenport, C&EN, Vol. 92, Iss. 45, pp. 10-13. Link do artykułu internetowego znajdziesz tutaj.
#MBF